
【背景了解】
多年来,用于蛋白质结合和组装的新方法为各种生物活性蛋白质水凝胶开辟了场所。这些基于蛋白质的材料因其遗传可编程性和功能多样性而闻名,它们已成为替代其他天然或合成聚合物的有前途的替代品。例如,使用SpyTag/SpyCatcher或SnoopTag/SnoopCatcher等基因编码的点击化学试剂(一种可以通过形成异肽键将蛋白质分子共价结合在一起的肽/蛋白质对)导致了各种水凝胶和“活”软材料。与由合成聚合物或天然前体制备水凝胶的努力相比,这种设计水凝胶的方法的优势在于,它无需化学修饰,并具有更好的细胞或生物相容性。然而,为了形成生物活性水凝胶,必须明智地将那些蛋白质构件设计为具有适当的多个反应域,就容易制造和生物功能化而言,很难将其推广。

【科研摘要】
轴突再生构成了再生神经生物学的一项基本挑战,这需要使用量身定制的生物材料来控制细胞和生物分子的传递。创建这些材料的一种越来越流行的方法是将工程蛋白质直接组装成高阶结构,该过程通常依赖于复杂的蛋白质化学。先前,香港科技大学Bojing Jiang,Chao Yang和南方科技大学Xiaotian Liu等研究人员提出了一种简单的方法,用于通过His6标签蛋白的金属定向组装来创建可注射的光响应水凝胶。相关论文题为Injectable, photoresponsive hydrogels for delivering neuroprotective proteins enabled by metal-directed protein assembly发表在《Science Advances》上。B12依赖的感光蛋白CarHC可以通过氨基末端His6-tag与过渡金属离子络合,添加AdoB12后可以进一步经历溶胶-凝胶转变,从而形成具有明显可注射性和光降解性的水凝胶。可诱导的相变进一步使得细胞和蛋白质的容易包封和释放成为可能。将注射有白血病抑制因子修饰的Zn2+配位的凝胶注射到受伤的小鼠视神经中,导致延长的细胞信号传导和增强的轴突再生。这项研究说明了设计可注射生物材料的有效策略。
【图文解析】
1. 设计蛋白质构建体
为了检查使用金属离子将His6标记的重组蛋白组装到水凝胶中同时保留其分子功能的可行性,作者选择了His6标记的重组蛋白SpyTag-ELP-CarHC-ELP-SpyTag(ACA)作为模型系统(图1),以前在大肠杆菌中表现出明显的溶解性和表达产量。该构建体的主要结构域CarHC是B12依赖的感光体,它来自细菌转录调节剂,可控制类胡萝卜素色素的生物合成。AdoB12中的C-Co键对绿光(522 nm)敏感。CarHC在黑暗中与辅因子AdoB12结合后会自组装成四聚体,而在光照下会分解成单体,伴随着AdoB12中不稳定的C-Co键的裂解,4',5'-脱水腺苷的释放和 His132与Co中心的协调(图1)。
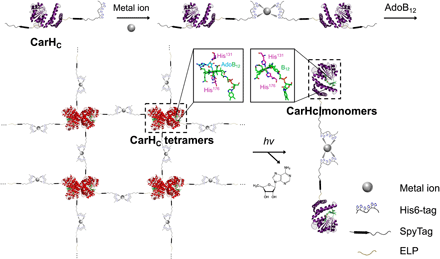
图1将带有His6标签的CarHC金属定向组装成光响应水凝胶。
2金属导向的蛋白质组装
在时间扫描模式下的流变学测量表明,在黑暗中添加AdoB12后,ACA/M2+复合物的胶凝动力学,其储能模量G'(实质上大于损耗模量G'')在15分钟内达到了平稳状态(图2A)。对所有四种类型的M2 +配位的凝胶进行扫频测试,发现在0.01至100 rad/s的频率范围内,G'~1 kPa和G''~0.1 kPa,证实了固体物质的形成(图2B)。只有Cu2+配位的凝胶显示出G'和G''高度依赖于剪切频率,而其他的则没有。在0.03 rad/s的频率处出现了G”的局部最大值,表明该材料具有粘弹性(图2B)。金属离子对给电子基团的亲和力通常遵循Cu2+>Ni2+> Zn2+≈Co2+的顺序,而它们对特定配体的选择性相反(Cu2+<Ni2+< Zn2+≈Co2+)。
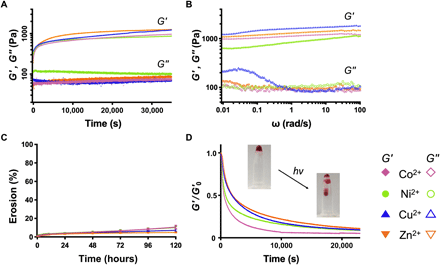
图2.金属配位蛋白网络的物理性质。
在黑暗中将凝胶与tris缓冲盐水(TBS)浸没在一起,导致5天后蛋白质损失少于10%,显示出这些金属配位蛋白质网络的显着稳定性(图2C)。同时,这些M2+配位的凝胶在连续白光发光二极管(LED)照明(35 klux)下经历了快速的凝胶-溶胶转变,并伴随着G'的明显降低,其强度可与室外日光(~10至 根据美国国家光学天文台(100 klux)(图2D)。这种光诱导的相变可归因于AdoB12的光解和蛋白质网络内四聚体CarHC的分解(图1)。
3.氧化还原反应性钴协同蛋白网络
Co2+络合物在热力学上是不稳定的,并且在动力学上不稳定,这与Co3+络合物在热力学上稳定并且配体交换明显缓慢形成鲜明对比。这种对比度是Co2+/Co3+所独有的,最近已被用于制造具有明显氧化还原反应性的水凝胶。
4.自修复和可注射性
应变扫描测试显示线性粘弹性区域具有变化的线性极限,线性极限取决于金属离子(图3,A至D)。含Co,Ni,Cu和Zn的凝胶分别在γy~100、70、50和141%处显示线性极限(屈服点),并且流动点(G'和G''曲线交叉,在γf分别为158%,177%,100%和250%时(图3,A至D)。连续的阶跃应变测量表明,在网络故障后,这些水凝胶可快速恢复。通过施加高应变(250%)500 s破坏水凝胶网络,从而导致呈液体状(G''> G')。切换到低振幅应变(5%)可立即恢复实体力学(G'> G”);即使在网络破裂6个周期后,G仍可以恢复(图3,E至H)。

图3在金属配位的CarHC水凝胶上进行的应变扫描测试。
5.细胞包封和光诱导释放
对于基础研究和基于细胞的疗法而言,能够轻松封装和回收细胞的物质系统是非常需要的。
首先检查了它们封装小鼠3T3成纤维细胞和人间充质干细胞(hMSCs)的能力。将细胞悬浮在ACA / Zn2+(1:2)溶液中,然后添加AdoB12以引发凝胶化。45分钟后,将凝胶浸入培养基中,并在黑暗中(37°C,5%CO2)孵育12小时。进行标准活/死染色测定以确定细胞活力。事实证明,封装12小时后,大多数成纤维细胞(90.0±3.6%)和MSC(88.0±1.4%)仍然可以存活(图4),证实了这些Zn2+配位的凝胶的细胞相容性。
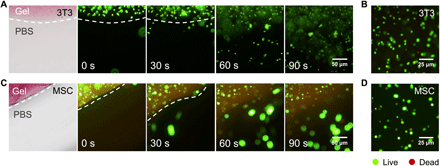
图4光诱导的封装细胞释放。
光照后,包封的细胞可在8分钟内轻松地从Zn2 +凝胶中释放出来,并伴随着凝胶-溶胶转变(图4)。这些金属配位的光响应水凝胶具有低毒性并且能够容易地进行细胞包封和回收,可以代表用于三维(3D)细胞培养和细胞移植的通用系统。
6.固定和释放His6标签的蛋白
由于蛋白质药物通常在体内具有短暂的半衰期,因此可控的释放/释放提供了提高其功效的可能途径。作者预见到,His6标记的蛋白可以很容易地通过金属配位固定在水凝胶网络上,然后可以通过光诱导的凝胶-溶胶转变而释放出来。
7.载有LIF的水凝胶用于持续信号转导和转录激活因子3的激活
先前的研究已经确定LIF具有神经保护作用,并促进轴突生长。还已经表明,将这种细胞因子注射到病变部位导致神经突生长增强,尽管程度适中。神经组织的刚度从接近人脑皮质板的~150 Pa到其根尖表面的~1500 Pa,与Zn2+配位的CarHC凝胶的G'(~1 kPa)相当。5天后,在黑暗和正常昼夜节律条件下,接受LIF载胶的视神经中STAT3磷酸化水平仍然很高,而使用LIF溶液的视神经中STAT3磷酸化水平仍然很高。不论光照条件如何,在注射了LIF的凝胶后5天,观察到大约60%的p-STAT3阳性RGC(图5)。
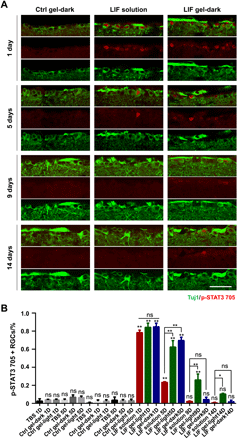
图5带有Zn2+配位的凝胶的His6标签LIF的可注射递送激活了STAT3途径。
8.载有LIF的水凝胶促进轴突再生
使用视神经挤压模型进一步研究了这些富含LIF的水凝胶对神经保护和轴突再生的影响。在视神经挤压后,向C57BL/6小鼠玻璃体内注射媒介物(TBS),TBS中的LIF溶液或载有LIF的凝胶。虽然注射LIF溶液对视神经压伤2周后对病变部位的RGC存活率几乎没有影响,但在黑暗和正常情况下,载有LIF的凝胶的给药会使活RGC的数量增加约30%昼夜节律条件,这些凝胶在体内显示出更好的神经保护作用。
与TBS处理的小鼠相比,轴突再生很少(约200个)穿过病变部位,而注射LIF溶液或载有LIF的凝胶可显着增强轴突再生,特别是在≥0.2mm的轴突再生中。长度(图6)。此外,在正常的昼夜节律和黑暗条件下,用载有LIF的凝胶处理的组均显示出大量的再生轴突,其长度≥0.2 mm(亮,~1600;暗,~1800),比用LIF处理的组更多。LIF溶液(~900),表明这些蛋白质凝胶传递LIF能够促进轴突再生(图6)。
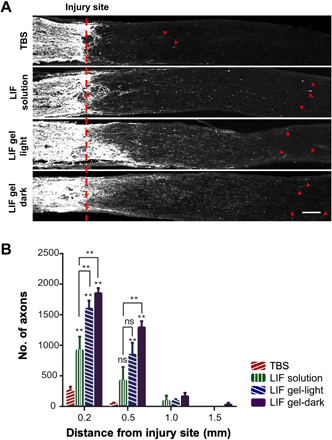
图6.带有Zn2+配位的凝胶的His6标签LIF的可注射递送促进视神经中的轴突再生。
参考文献:
DOI: 10.1126/sciadv.abc4824




